Expo
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Química ClínicaDiagnóstico MolecularHematologíaInmunologíaMicrobiologíaPatologíaTecnologíaIndustria
Eventos
Webinars

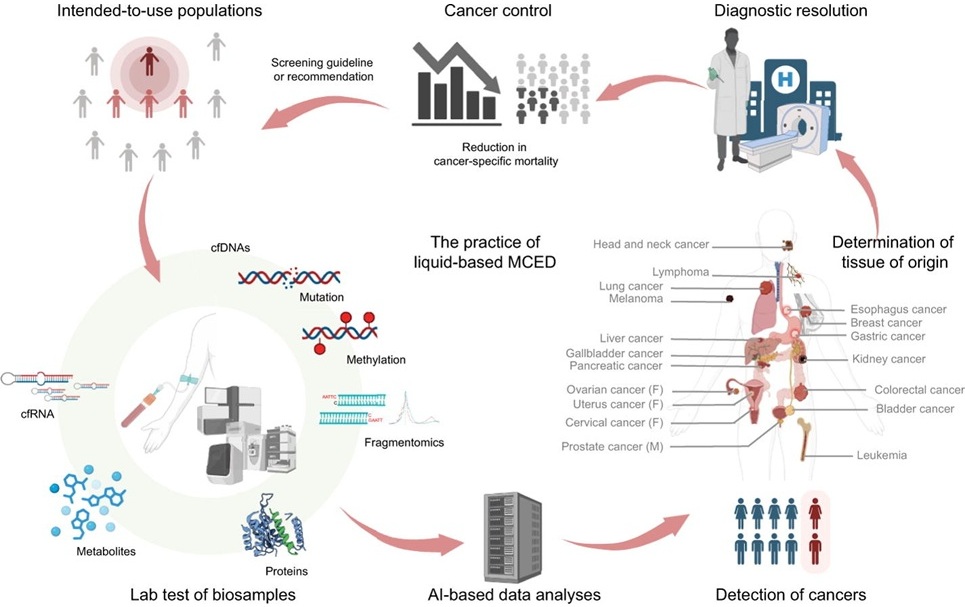
- Procedimiento de medición referencial estandariza resultados de pruebas de amplificación de ácidos nucleicos
- Herramienta tipo bolígrafo rápida y no invasiva detecta opioides en piel
- Simple prueba de orina podría detectar múltiples cánceres en etapa temprana
- Prueba de cerumen detecta con precisión Parkinson identificando moléculas de olor
- Método cuantitativo evalúa exposición a opioides en recién nacidos
- Sistema de diagnóstico molecular proporciona resultados POC con calidad de laboratorio
- Firma celular identifica pacientes con tumores de próstata resistentes al tratamiento
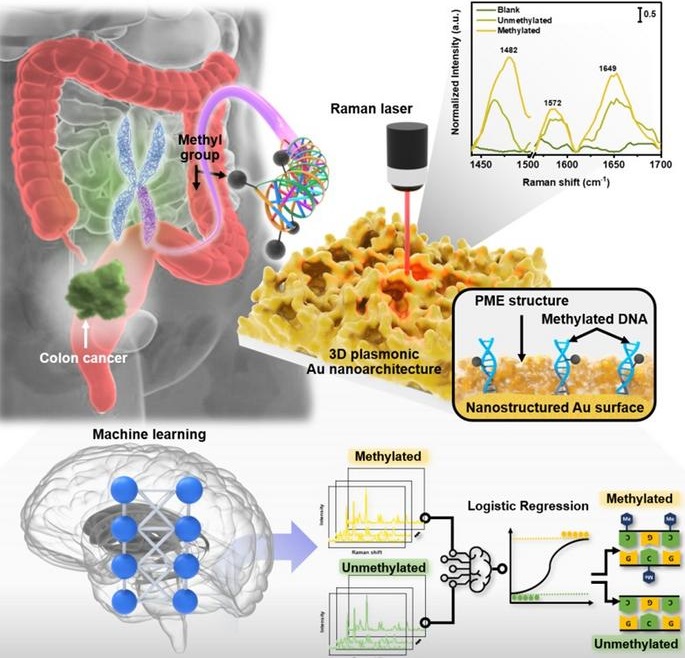
- DTMC podría ser valioso complemento a métodos tradicionales de detección del cáncer
- Tecnología reciente cambia reglas del juego para diagnóstico de enfermedad de Lyme
- Prueba de biopsia líquida utiliza ARN para detectar cáncer en etapa temprana
- Primera prueba de monitorización de heparina POC proporciona resultados rápidos
- Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
- Prueba prenatal no invasiva para determinar estado RhD del feto es 100 % precisa
- Recuento de leucocitos predice gravedad de síntomas de COVID-19
- Tecnología de recuento de plaquetas ayudará a prevenir errores de diagnóstico
- Innovadora prueba de flujo lateral cuantifica nucleosomas en sangre venosa completa en minutos
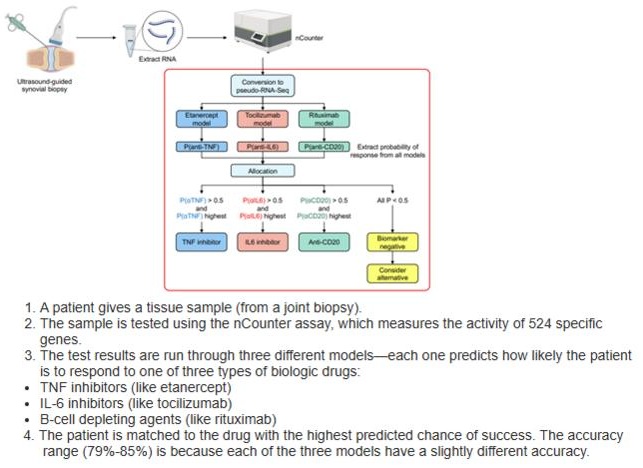
- Primera prueba clínica del mundo predice mejor tratamiento para artritis reumatoide
- Análisis de sangre detecta rechazo en pacientes con trasplante de corazón
- Enfoque de biopsia líquida transforma diagnóstico, seguimiento y tratamiento del cáncer de pulmón
- Herramienta computacional expone cambios en ADN canceroso que influyen en resistencia al tratamiento
- Análisis de microbiota intestinal permite detección temprana y no invasiva de diabetes gestacional
- Prueba tamaño de tarjeta mejora detección de tuberculosis en zonas altas en VIH
- Perfil de metabolitos fecales predice mortalidad en pacientes críticos
- Sistema portátil de análisis molecular POC descarta infecciones urinarias en 35 minutos
- Prueba de flujo lateral POC detecta infección fúngica mortal más rápido que técnicas existentes
- Biosensor ultrasensible basado en luz e IA permite diagnóstico temprano del cáncer
- Tecnología de biodetección económica localiza biomarcadores de enfermedades en minutos
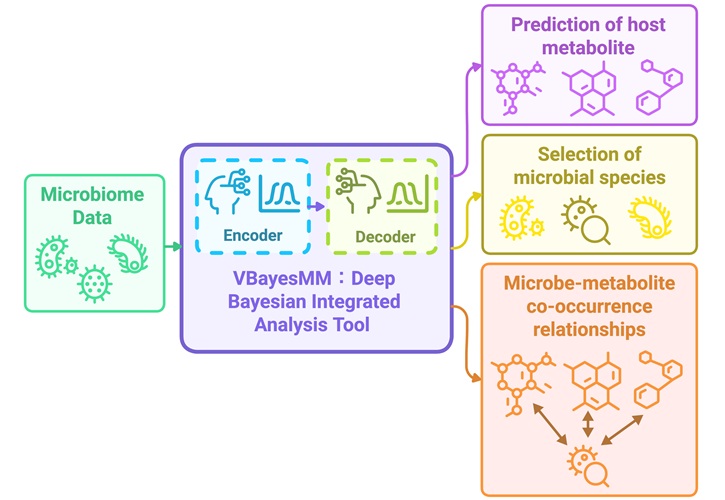
- Herramienta de IA podría ayudar a identificar objetivos bacterianos intestinales específicos para tratamiento de enfermedades
- Electrodo económico recubierto de ADN abre camino a diagnósticos desechables
- Nuevo dispositivo miniatura transforma pruebas de tratamientos contra cáncer de sangre
- Lunit y Microsoft impulsan diagnóstico del cáncer basado en IA
- La AMP publica guía de mejores prácticas para laboratorios clínicos que ofrecen pruebas HRD
- Illumina adquiere SomaLogic y acelera su negocio de proteómica
- Qiagen y Gencurix se asocian para desarrollar el ensayo de PCR IVD digital QIAcuity
- QIAGEN e Incyte firman acuerdo de colaboración en medicina de precisión
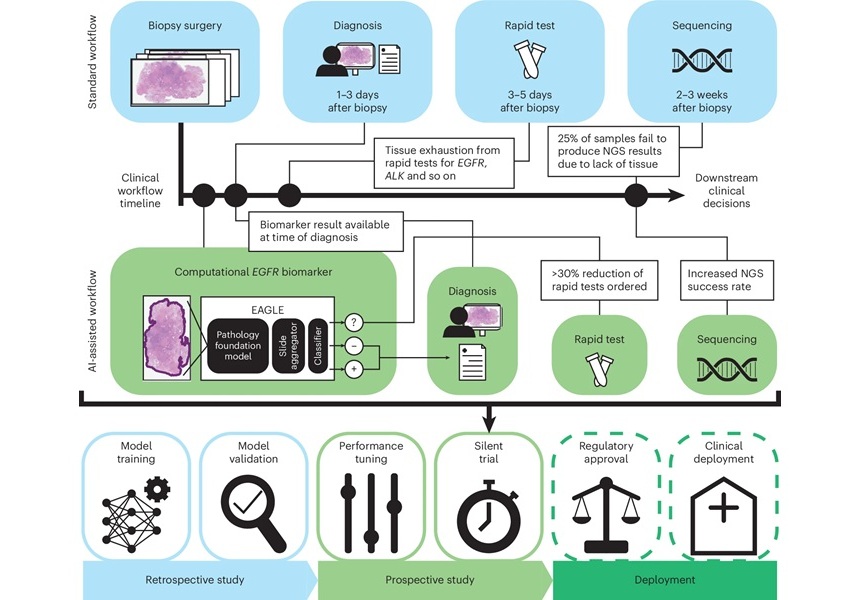
- Herramienta de IA mejora interpretación de patólogos de muestras de tejido
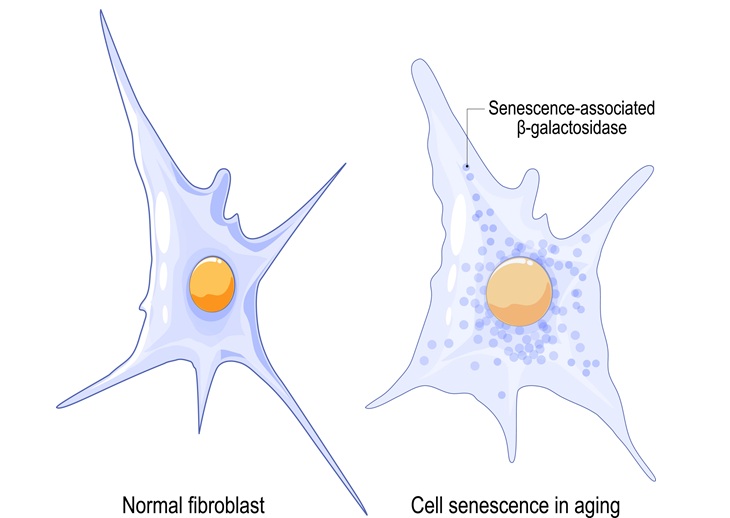
- Técnica asistida por IA rastrea células dañadas por lesiones, envejecimiento y enfermedades
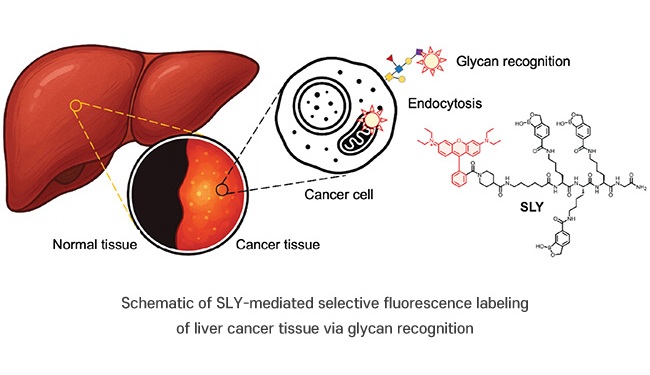
- Nueva sonda fluorescente muestra potencial en diagnóstico preciso del cáncer y cirugía guiada por fluorescencia
- Nuevo modelo de laboratorio ayudar a encontrar tratamientos para cáncer de sangre agresivo
- Microscopía con IA mejora detección de infecciones parasitarias intestinales

 Expo
Expo
- Procedimiento de medición referencial estandariza resultados de pruebas de amplificación de ácidos nucleicos
- Herramienta tipo bolígrafo rápida y no invasiva detecta opioides en piel
- Simple prueba de orina podría detectar múltiples cánceres en etapa temprana
- Prueba de cerumen detecta con precisión Parkinson identificando moléculas de olor
- Método cuantitativo evalúa exposición a opioides en recién nacidos
- Sistema de diagnóstico molecular proporciona resultados POC con calidad de laboratorio
- Firma celular identifica pacientes con tumores de próstata resistentes al tratamiento
- DTMC podría ser valioso complemento a métodos tradicionales de detección del cáncer
- Tecnología reciente cambia reglas del juego para diagnóstico de enfermedad de Lyme
- Prueba de biopsia líquida utiliza ARN para detectar cáncer en etapa temprana
- Primera prueba de monitorización de heparina POC proporciona resultados rápidos
- Nuevo sistema de puntuación predice riesgo de cáncer a partir de un trastorno sanguíneo común
- Prueba prenatal no invasiva para determinar estado RhD del feto es 100 % precisa
- Recuento de leucocitos predice gravedad de síntomas de COVID-19
- Tecnología de recuento de plaquetas ayudará a prevenir errores de diagnóstico
- Innovadora prueba de flujo lateral cuantifica nucleosomas en sangre venosa completa en minutos
- Primera prueba clínica del mundo predice mejor tratamiento para artritis reumatoide
- Análisis de sangre detecta rechazo en pacientes con trasplante de corazón
- Enfoque de biopsia líquida transforma diagnóstico, seguimiento y tratamiento del cáncer de pulmón
- Herramienta computacional expone cambios en ADN canceroso que influyen en resistencia al tratamiento
- Análisis de microbiota intestinal permite detección temprana y no invasiva de diabetes gestacional
- Prueba tamaño de tarjeta mejora detección de tuberculosis en zonas altas en VIH
- Perfil de metabolitos fecales predice mortalidad en pacientes críticos
- Sistema portátil de análisis molecular POC descarta infecciones urinarias en 35 minutos
- Prueba de flujo lateral POC detecta infección fúngica mortal más rápido que técnicas existentes
- Biosensor ultrasensible basado en luz e IA permite diagnóstico temprano del cáncer
- Tecnología de biodetección económica localiza biomarcadores de enfermedades en minutos
- Herramienta de IA podría ayudar a identificar objetivos bacterianos intestinales específicos para tratamiento de enfermedades
- Electrodo económico recubierto de ADN abre camino a diagnósticos desechables
- Nuevo dispositivo miniatura transforma pruebas de tratamientos contra cáncer de sangre
- Lunit y Microsoft impulsan diagnóstico del cáncer basado en IA
- La AMP publica guía de mejores prácticas para laboratorios clínicos que ofrecen pruebas HRD
- Illumina adquiere SomaLogic y acelera su negocio de proteómica
- Qiagen y Gencurix se asocian para desarrollar el ensayo de PCR IVD digital QIAcuity
- QIAGEN e Incyte firman acuerdo de colaboración en medicina de precisión
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Herramienta de IA mejora interpretación de patólogos de muestras de tejido
- Técnica asistida por IA rastrea células dañadas por lesiones, envejecimiento y enfermedades
- Nueva sonda fluorescente muestra potencial en diagnóstico preciso del cáncer y cirugía guiada por fluorescencia
- Nuevo modelo de laboratorio ayudar a encontrar tratamientos para cáncer de sangre agresivo
- Microscopía con IA mejora detección de infecciones parasitarias intestinales