Expo
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Química ClínicaDiagnóstico MolecularHematologíaInmunologíaMicrobiologíaPatologíaTecnologíaIndustria
Eventos
Webinars

- Simple análisis sanguíneo ofrece nueva vía para evaluación del Alzheimer en atención primaria
- Analizadores hospitalarios existentes pueden identificar productos médicos líquidos falsos
- Método rápido de análisis sanguíneo permite decisiones más seguras en emergencias por medicamentos
- Modelo pronóstico basado en APE mejora evaluación del riesgo de cáncer
- Vesículas extracelulares se relacionan con riesgo de insuficiencia cardíaca en pacientes con ERC
- Nuevo análisis de sangre predice quienes tienen más probabilidades de vivir más
- Prueba genética predice riesgo de radioterapia en pacientes con cáncer de próstata
- Prueba genética facilita detección temprana y mejora tratamiento del cáncer
- Nueva técnica de secuenciación genómica mide virus de Epstein-Barr en sangre
- Análisis de sangre mejora detección temprana del cáncer cerebral
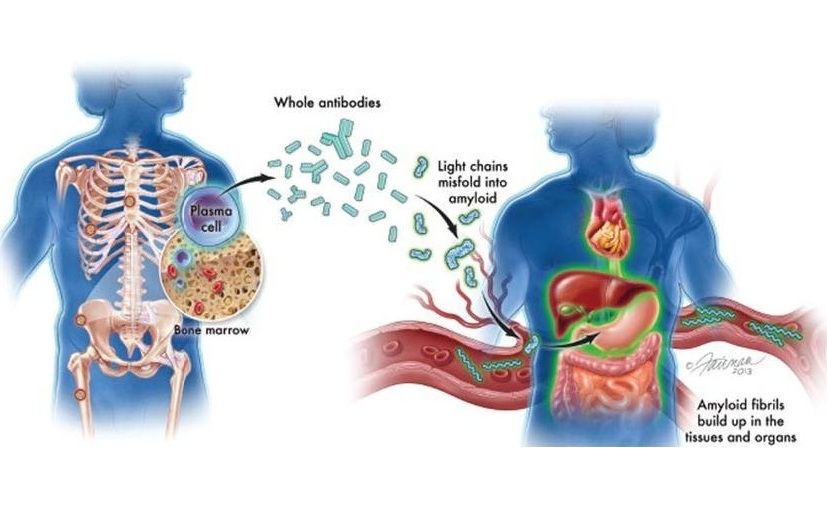
- Nuevas directrices buscan mejorar diagnóstico de amiloidosis AL
- Sistema automatizado de hemostasia ayuda a laboratorios a optimizar flujo de trabajo
- Prueba rápida y sencilla podría revolucionar transfusiones de sangre
- Análisis de sangre muy sensible mejora evaluación del riesgo de coagulación en pacientes cardíacos
- Algoritmo de IA distingue eficazmente subtipos de alfa talasemia
- Análisis de sangre identifica pacientes con cáncer pulmonar beneficiarios de fármaco de inmunoterapia
- Enfoque de secuenciación genómica completa identifica pacientes con cáncer beneficiarios con inhibidores de PARP
- Biopsia líquida ultrasensible demuestra eficacia para predecir respuesta a inmunoterapia
- Análisis sanguíneo identifica pacientes con cáncer de colon que se benefician de AINE
- Análisis sanguíneo podría detectar efectos adversos de inmunoterapia
- Panel de tres pruebas para detección de infecciones por duelas del hígado
- Prueba rápida promete respuestas inmediatas a infecciones resistentes a medicamentos
- Tecnología con CRISPR neutraliza bacterias resistentes a antibióticos
- Nuevo estudio identifica características del microbioma intestinal asociadas con enfermedad de Alzheimer
- Plataforma de IA permite detección rápida de patógenos de C. auris resistentes a fármacos
- Biomarcador de IA predice riesgo de cáncer de hígado
- Tecnología robótica para extracciones de sangre diagnósticas automatizadas
- ADLM lanza programa de ciencia de datos único para profesionales de medicina de laboratorio
- Tecnología de biosensores de aptámeros transforma detección de virus
- Análisis de sangre de rutina y modelos de IA podrían predecir preeclampsia y anemia
- QuidelOrtho colabora con Lifotronic para ampliar cartera global de inmunoensayos
- WHX Labs en Dubái resalta habilidades de liderazgo que forman laboratorios de próxima generación
- Prueba de cáncer cervical con IA lista para lanzamiento en América Latina
- Nueva colaboración lleva espectrometría de masas automatizada a pruebas de laboratorio de rutina
- Diasorin y Fisher Scientific firman acuerdo de distribución en EUA para plataforma POC molecular
- Escaneo 3D con IA acelera detección del cáncer
- Clasificador de muestras únicas predice subtipos de fibroblastos asociados al cáncer
- Plataforma de IA estandariza flujo de trabajo de microscopía de frotis de tuberculosis
- Herramienta de IA predice complicaciones del trasplante mediante biomarcadores sanguíneos antes de síntomas
- Imágenes de alta resolución del virus del cáncer revelan posibles objetivos terapéuticos

 Expo
Expo
- Simple análisis sanguíneo ofrece nueva vía para evaluación del Alzheimer en atención primaria
- Analizadores hospitalarios existentes pueden identificar productos médicos líquidos falsos
- Método rápido de análisis sanguíneo permite decisiones más seguras en emergencias por medicamentos
- Modelo pronóstico basado en APE mejora evaluación del riesgo de cáncer
- Vesículas extracelulares se relacionan con riesgo de insuficiencia cardíaca en pacientes con ERC
- Nuevo análisis de sangre predice quienes tienen más probabilidades de vivir más
- Prueba genética predice riesgo de radioterapia en pacientes con cáncer de próstata
- Prueba genética facilita detección temprana y mejora tratamiento del cáncer
- Nueva técnica de secuenciación genómica mide virus de Epstein-Barr en sangre
- Análisis de sangre mejora detección temprana del cáncer cerebral
- Nuevas directrices buscan mejorar diagnóstico de amiloidosis AL
- Sistema automatizado de hemostasia ayuda a laboratorios a optimizar flujo de trabajo
- Prueba rápida y sencilla podría revolucionar transfusiones de sangre
- Análisis de sangre muy sensible mejora evaluación del riesgo de coagulación en pacientes cardíacos
- Algoritmo de IA distingue eficazmente subtipos de alfa talasemia
- Análisis de sangre identifica pacientes con cáncer pulmonar beneficiarios de fármaco de inmunoterapia
- Enfoque de secuenciación genómica completa identifica pacientes con cáncer beneficiarios con inhibidores de PARP
- Biopsia líquida ultrasensible demuestra eficacia para predecir respuesta a inmunoterapia
- Análisis sanguíneo identifica pacientes con cáncer de colon que se benefician de AINE
- Análisis sanguíneo podría detectar efectos adversos de inmunoterapia
- Panel de tres pruebas para detección de infecciones por duelas del hígado
- Prueba rápida promete respuestas inmediatas a infecciones resistentes a medicamentos
- Tecnología con CRISPR neutraliza bacterias resistentes a antibióticos
- Nuevo estudio identifica características del microbioma intestinal asociadas con enfermedad de Alzheimer
- Plataforma de IA permite detección rápida de patógenos de C. auris resistentes a fármacos
- Biomarcador de IA predice riesgo de cáncer de hígado
- Tecnología robótica para extracciones de sangre diagnósticas automatizadas
- ADLM lanza programa de ciencia de datos único para profesionales de medicina de laboratorio
- Tecnología de biosensores de aptámeros transforma detección de virus
- Análisis de sangre de rutina y modelos de IA podrían predecir preeclampsia y anemia
- QuidelOrtho colabora con Lifotronic para ampliar cartera global de inmunoensayos
- WHX Labs en Dubái resalta habilidades de liderazgo que forman laboratorios de próxima generación
- Prueba de cáncer cervical con IA lista para lanzamiento en América Latina
- Nueva colaboración lleva espectrometría de masas automatizada a pruebas de laboratorio de rutina
- Diasorin y Fisher Scientific firman acuerdo de distribución en EUA para plataforma POC molecular
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Escaneo 3D con IA acelera detección del cáncer
- Clasificador de muestras únicas predice subtipos de fibroblastos asociados al cáncer
- Plataforma de IA estandariza flujo de trabajo de microscopía de frotis de tuberculosis
- Herramienta de IA predice complicaciones del trasplante mediante biomarcadores sanguíneos antes de síntomas
- Imágenes de alta resolución del virus del cáncer revelan posibles objetivos terapéuticos