Expo
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Química Clínica
HematologíaInmunologíaMicrobiologíaPatologíaTecnologíaIndustria
Eventos
Webinars

- Sistema compacto de imágenes Raman detecta señales tumorales sutiles
- Monitoreo no invasivo de glucosa reemplaza pinchazos en dedo en diabéticos
- Diagnóstico de aliento POC detecta patógenos causantes de neumonía
- Herramienta en línea detecta exposición a medicamentos directamente en muestras de pacientes
- Sonda de imágenes químicas podría rastrear y tratar cáncer de próstata
- Pruebas genéticas mejoran detección integral del cáncer mamario basada en riesgo
- Prueba de orina podría revelar edad real y esperanza de vida
- Prueba genómica identifica afroamericanos en riesgo de recurrencia temprana del cáncer de próstata
- Análisis de sangre podría identificar biomarcador de malaria cerebral
- Primer análisis sanguíneo con biomarcadores para evaluar progresión de EM
- Análisis sanguíneo de actividad plaquetaria en mediana edad podría identificar riesgo temprano de Alzheimer
- Medición de microvesículas podría detectar lesiones vasculares en pacientes con anemia falciforme
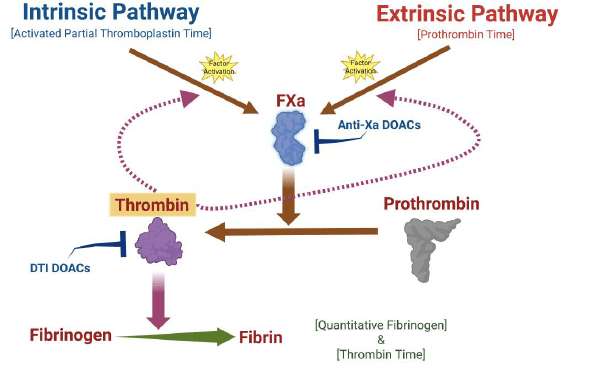
- Nueva guía de ADLM sobre pruebas de coagulación mejora atención a pacientes que toman anticoagulantes
- Pruebas viscoelásticas podrían mejorar tratamiento de hemorragia materna
- Modelo mide exposición a radiación en sangre para tratamientos precisos contra cáncer
- Análisis sanguíneo identifica pacientes con cáncer de colon que se benefician de AINE
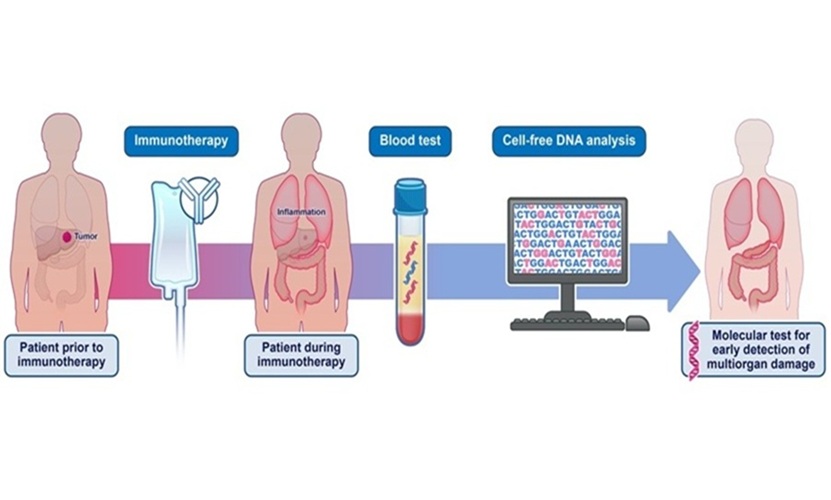
- Análisis sanguíneo podría detectar efectos adversos de inmunoterapia
- Análisis de sangre rutinario puede predecir mayor beneficiario de terapia con células T CAR
- Nueva prueba distingue falsos positivos inducidos por vacuna de infección activa por VIH
- Prueba de firma genética predice respuesta a tratamientos clave para cáncer de mama
- Avances en análisis microbiano mejora predicción de enfermedades
- Método de diagnóstico en sangre identifica infecciones IVRI pediátricas
- Prueba de diagnóstico rápido es estándar de oro para detección de sepsis
- Prueba rápida de tuberculosis POC proporciona resultados en 15 minutos
- Ensayo rápido identifica patógenos de infecciones sanguíneas directamente en muestras de pacientes
- IA predice supervivencia del cáncer colorrectal mediante características clínicas y moleculares
- Chip de diagnóstico monitoriza eficacia de quimioterapia contra cáncer cerebral
- Modelos de aprendizaje automático diagnostican ELA antes mediante biomarcadores sanguíneos
- Modelo de inteligencia artificial podría acelerar diagnóstico de enfermedades raras
- Sensor de saliva con IA permite detección precoz del cáncer de cabeza y cuello
- Abbott adquiere Exact Sciences, empresa de detección de cáncer
- Roche y Freenome colaboran para desarrollar pruebas de detección del cáncer
- Co-Diagnostics crea nueva unidad de negocio para desarrollar diagnósticos con IA
- Qiagen adquiere empresa de ómica unicelular Parse Biosciences
- Puritan Medical Products presenta sus innovaciones en AMP2025 en Boston
- Herramienta de IA identifica simultáneamente mutaciones genéticas y tipos de enfermedades
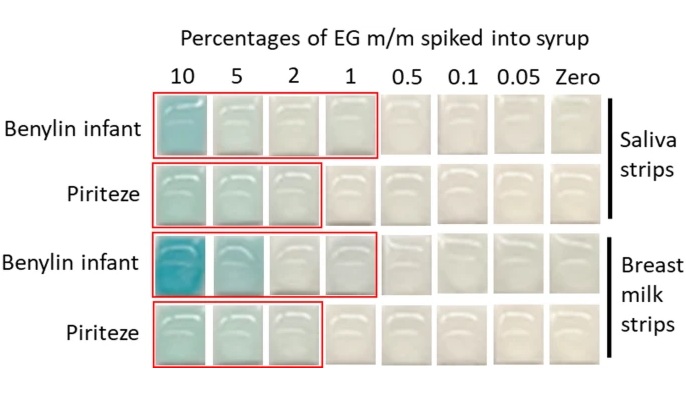
- Pruebas rápidas y económicas pueden prevenir muertes infantiles por jarabes medicinales contaminados
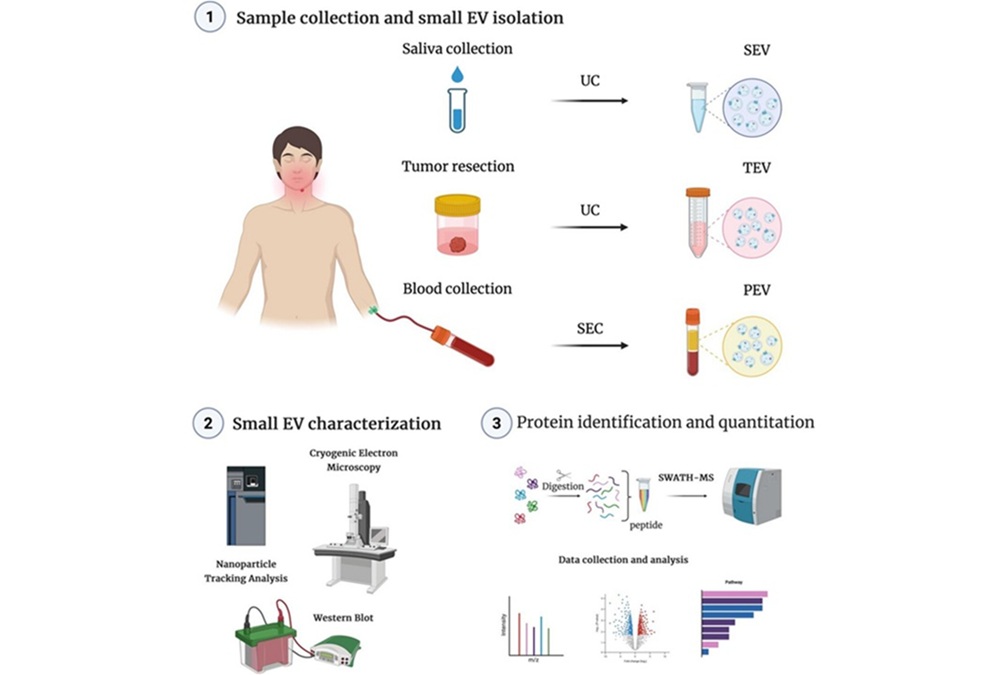
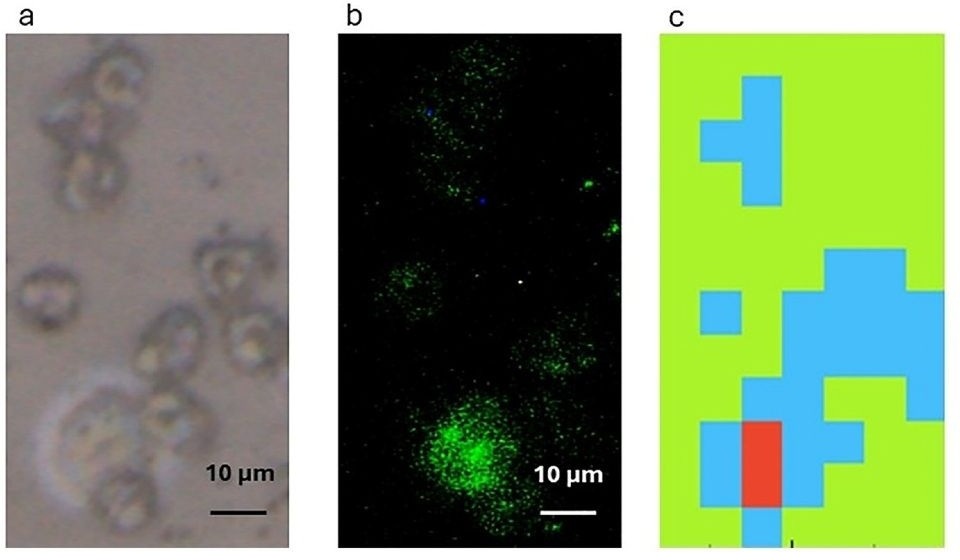
- Señales tumorales en saliva y sangre permiten monitorización no invasiva del cáncer de cabeza y cuello
- Problemas de salud comunes pueden influir en nuevos análisis sanguíneos para enfermedad de Alzheimer
- Fórmula de análisis sanguíneo identifica pacientes con enfermedad hepática crónica con mayor riesgo de cáncer

 Expo
Expo
- Sistema compacto de imágenes Raman detecta señales tumorales sutiles
- Monitoreo no invasivo de glucosa reemplaza pinchazos en dedo en diabéticos
- Diagnóstico de aliento POC detecta patógenos causantes de neumonía
- Herramienta en línea detecta exposición a medicamentos directamente en muestras de pacientes
- Sonda de imágenes químicas podría rastrear y tratar cáncer de próstata
- Pruebas genéticas mejoran detección integral del cáncer mamario basada en riesgo
- Prueba de orina podría revelar edad real y esperanza de vida
- Prueba genómica identifica afroamericanos en riesgo de recurrencia temprana del cáncer de próstata
- Análisis de sangre podría identificar biomarcador de malaria cerebral
- Primer análisis sanguíneo con biomarcadores para evaluar progresión de EM
- Análisis sanguíneo de actividad plaquetaria en mediana edad podría identificar riesgo temprano de Alzheimer
- Medición de microvesículas podría detectar lesiones vasculares en pacientes con anemia falciforme
- Nueva guía de ADLM sobre pruebas de coagulación mejora atención a pacientes que toman anticoagulantes
- Pruebas viscoelásticas podrían mejorar tratamiento de hemorragia materna
- Modelo mide exposición a radiación en sangre para tratamientos precisos contra cáncer
- Análisis sanguíneo identifica pacientes con cáncer de colon que se benefician de AINE
- Análisis sanguíneo podría detectar efectos adversos de inmunoterapia
- Análisis de sangre rutinario puede predecir mayor beneficiario de terapia con células T CAR
- Nueva prueba distingue falsos positivos inducidos por vacuna de infección activa por VIH
- Prueba de firma genética predice respuesta a tratamientos clave para cáncer de mama
- Avances en análisis microbiano mejora predicción de enfermedades
- Método de diagnóstico en sangre identifica infecciones IVRI pediátricas
- Prueba de diagnóstico rápido es estándar de oro para detección de sepsis
- Prueba rápida de tuberculosis POC proporciona resultados en 15 minutos
- Ensayo rápido identifica patógenos de infecciones sanguíneas directamente en muestras de pacientes
- IA predice supervivencia del cáncer colorrectal mediante características clínicas y moleculares
- Chip de diagnóstico monitoriza eficacia de quimioterapia contra cáncer cerebral
- Modelos de aprendizaje automático diagnostican ELA antes mediante biomarcadores sanguíneos
- Modelo de inteligencia artificial podría acelerar diagnóstico de enfermedades raras
- Sensor de saliva con IA permite detección precoz del cáncer de cabeza y cuello
- Abbott adquiere Exact Sciences, empresa de detección de cáncer
- Roche y Freenome colaboran para desarrollar pruebas de detección del cáncer
- Co-Diagnostics crea nueva unidad de negocio para desarrollar diagnósticos con IA
- Qiagen adquiere empresa de ómica unicelular Parse Biosciences
- Puritan Medical Products presenta sus innovaciones en AMP2025 en Boston
- Encuentran etiologías de COVID prolongada en muestras de sangre con infección aguda
- Dispositivo novedoso detecta anticuerpos contra la COVID-19 en cinco minutos
- Prueba para COVID-19 mediante CRISPR detecta SARS-CoV-2 en 30 minutos usando tijeras genéticas
- Asocian disbiosis del microbioma intestinal con la COVID-19
- Validan prueba rápida novedosa de antígeno para el SARS-CoV-2 con respecto a su exactitud diagnóstica
- Herramienta de IA identifica simultáneamente mutaciones genéticas y tipos de enfermedades
- Pruebas rápidas y económicas pueden prevenir muertes infantiles por jarabes medicinales contaminados
- Señales tumorales en saliva y sangre permiten monitorización no invasiva del cáncer de cabeza y cuello
- Problemas de salud comunes pueden influir en nuevos análisis sanguíneos para enfermedad de Alzheimer
- Fórmula de análisis sanguíneo identifica pacientes con enfermedad hepática crónica con mayor riesgo de cáncer